luokat: Esitetyt artikkelit » Aloittelijat
Katselukertoja: 52646
Kommentit artikkeliin: 4
Transistoria. Osa 2. Johtimet, eristeet ja puolijohteet
Artikkelin alku: Transistorin historia, Transistorit: tarkoitus, laite ja toimintaperiaatteet
 Sähkötekniikassa käytetään erilaisia materiaaleja. Aineiden sähköiset ominaisuudet määräytyvät ulkovalenssin kiertoradalla olevien elektronien lukumäärän perusteella. Mitä vähemmän elektronia on tällä kiertoradalla, sitä heikompia ne liittyvät ytimeen, sitä helpommin ne voivat matkustaa.
Sähkötekniikassa käytetään erilaisia materiaaleja. Aineiden sähköiset ominaisuudet määräytyvät ulkovalenssin kiertoradalla olevien elektronien lukumäärän perusteella. Mitä vähemmän elektronia on tällä kiertoradalla, sitä heikompia ne liittyvät ytimeen, sitä helpommin ne voivat matkustaa.
Lämpötilavaihteluiden vaikutuksesta elektronit irtautuvat atomista ja liikkuvat interatomisessa tilassa. Tällaisia elektronia kutsutaan vapaiksi, ja ne luovat sähkövirran johtimissa. Onko olemassa suuri interatominen tila, onko tilaa vapaille elektroneille liikkua aineen sisällä?
Kiintoaineiden ja nesteiden rakenne näyttää jatkuvalta ja tiheältä, muistuttaen lankapalloa. Mutta itse asiassa jopa kiinteät aineet ovat enemmän kuin kalastus- tai lentopalloverkkoja. Tätä ei tietenkään voida havaita kotitalouden tasolla, mutta tarkkoilla tieteellisillä tutkimuksilla on osoitettu, että elektronien ja atomien ytimen väliset etäisyydet ovat paljon suurempia kuin heidän omat mitat.
Jos atomin ytimen koko on esitetty pallon muodossa, jonka koko on jalkapallo, niin tämän mallin elektronit ovat herneen kokoisia, ja jokainen tällainen herne sijaitsee "ytimestä" useiden satojen ja jopa tuhansien metrien etäisyydellä. Ja ytimen ja elektronin välillä on tyhjyyttä - ei yksinkertaisesti ole mitään! Jos kuvittelemme matkan matemaattisten atomien välillä samassa mittakaavassa, mitat osoittautuvat lainkaan fantastisiksi - kymmeniä ja satoja kilometrejä!
Hyvät sähkönjohtimet ovat metallit. Esimerkiksi kullan ja hopean atomilla on vain yksi elektroni ulommalla kiertoradalla, joten ne ovat parhaita johtimia. Rauta johtaa myös sähköä, mutta hieman huonommin.
Suorita sähkö entistä huonommin erittäin kestävät seokset. Näitä ovat nikromi, manganiini, konstantaani, fechral ja muut. Tällainen valikoima korkearesistenssejä seoksia johtuu siitä, että ne on suunniteltu ratkaisemaan erilaisia ongelmia: lämmityselementit, venymittarit, mittauslaitteiden vertailuvastukset ja paljon muuta.
Materiaalin kykyä johtaa sähköä voidaan arvioida käsitteellä "Sähkönjohtavuus". Palautusarvo on resistiivisyys. Mekaniikassa nämä käsitteet vastaavat ominaispainoa.
eristeettoisin kuin johtimet, eivät ole taipuvaisia menettämään elektroneja. Sidos elektronin ja ytimen välillä on niissä erittäin vahva, eikä vapaita elektroneja ole melkein ollenkaan. Tarkemmin sanottuna, mutta hyvin harvat. Samanaikaisesti eräitä eristeitä on enemmän ja eristyslaatu on vastaavasti huonompi. Riittää verrata esimerkiksi keramiikkaa ja paperia. Siksi eristimet voidaan ehdollisesti jakaa hyviin ja huonoihin.
Vapaiden varausten esiintyminen jopa eristeissä johtuu elektronien lämpövärähtelyistä: korkean lämpötilan vaikutuksesta eristysominaisuudet huononevat, jotkut elektronit edelleen onnistuneesti murtuvat ytimestä.
Samoin ihanteellisen johtimen resistiivisyys olisi nolla. Mutta onneksi tällaista kapellimestaria ei ole: kuvittele, miltä Ohmin laki ((I = U / R) näyttäisi nollalla nimittäjässä !!! Jäähyväiset matematiikkaan ja sähkötekniikkaan.
Ja vain absoluuttisen nollan (-273,2 ° C) lämpötilassa lämpövaihtelut pysähtyvät kokonaan, ja pahimmasta eristeestä tulee tarpeeksi hyvä. Jotta voidaan määrittää numeerisesti ”tämä” on huono - käytä vastuskäsitettä. Tämä on vastus ohmeissa kuutiolle, jonka reunan pituus on 1 cm, resistiivisyysmitta saadaan ohmeina / cm. Joidenkin aineiden ominaisresistenssi on esitetty alla.Johtavuus on resistiivisyyden vastavuoro, on Siemensin mittayksikkö, - 1Sm = 1 / oh.
Niiden johtavuus on hyvä tai alhainen resistiivisyys: hopea 1,5 * 10 ^ (- 6), lue kuinka (puolitoista kymmeneen voimaan miinus kuusi), kupari 1,78 * 10 ^ (- 6), alumiini 2,8 * 10 ^ (- 6). Korkean resistanssin omaavien seosten johtavuus on paljon huonompi: vakio 0,5 * 10 ^ (- 4), nikromi 1,1 * 10 ^ (- 4). Näitä seoksia voidaan kutsua huonoiksi johtimiksi. Korvaa kaikkien näiden monimutkaisten lukujen jälkeen ohm / cm.
Lisäksi puolijohteet voidaan erottaa erillisenä ryhmänä: germanium 60 ohmia / cm, piitä 5000 ohmia / cm, seleeni 100 000 ohmia / cm. Tämän ryhmän resistiivisyys on suurempi kuin huonojen johtimien, mutta vähemmän kuin huonojen eristimien, puhumattakaan hyvistä. Todennäköisesti, samalla menestyksellä, puolijohteita voitaisiin kutsua puolieristeiksi.
Tällaisen lyhyen tutustumisen jälkeen atomin rakenteeseen ja ominaisuuksiin tulisi harkita kuinka atomit vuorovaikutuksessa toistensa kanssa, kuinka atomit ovat vuorovaikutuksessa keskenään, miten niistä tehdään molekyylejä, joista eri aineet koostuvat. Tätä varten joudut jälleen muistamaan atomin ulkoradalla olevat elektronit. Loppujen lopuksi juuri ne osallistuvat atomien sitoutumiseen molekyyleihin ja määräävät aineen fysikaaliset ja kemialliset ominaisuudet.
Kuinka atomit tehdään atomista
Mikä tahansa atomi on vakaassa tilassa, jos sen ulkoradalla on 8 elektronia. Hän ei yritä ottaa elektronia naapuriatomeista, mutta hän ei luopu omista. Tämän todentamiseksi riittää, että jaksotaulukossa tarkastellaan inerttejä kaasuja: neonia, argonia, kryptonia, ksenonia. Jokaisella niistä on ulkoradalla 8 elektronia, mikä selittää näiden kaasujen haluttomuuden mahdollisiin suhteisiin (kemiallisiin reaktioihin) muiden atomien kanssa rakentaa kemiallisten aineiden molekyylejä.
Tilanne on aivan erilainen niillä atomilla, joiden ulkoradalla ei ole 8 vaalittua elektronia. Tällaiset atomit mieluummin yhdistyvät toisten kanssa täydentääkseen ulkoa kiertoradallaan jopa kahdella elektronilla ja löytääkseen rauhallisen vakaan tilan.
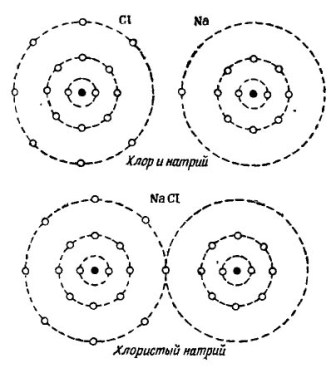
Esimerkiksi tunnettu vesimolekyyli H2O. Se koostuu kahdesta vetyatomista ja yhdestä happiatomista, kuten kuvassa on esitetty. 1.
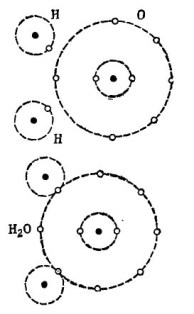
kuva 1. Kuinka vesimolekyyli luodaan.
Kuvan yläosassa kaksi vetyatomia ja yksi happiatomi on esitetty erikseen. Hapen ulkoradalla on 6 elektronia ja kaksi elektronia kahdessa vetyatomissa ovat lähellä. Happi kunnes rakastetusta numerosta 8 puuttuu vain kaksi elektronia ulommalla kiertoradalla, jonka hän saa lisäämällä kaksi vetyatomia itseensä.
Jokaisesta vetyatomista puuttuu 7 elektronia ulommalla kiertoradallaan täydellisen onnellisuuden saavuttamiseksi. Ensimmäinen vetyatomi vastaanottaa ulkoradallaansa 6 elektronia hapesta ja toinen elektroni kaksosistaan - toisesta vetyatomista. Sen ulkoradalla on nyt 8 elektronia yhdessä sen elektronin kanssa. Toinen vetyatomi myös täydentää ulkoradansa rakkaimpaan lukuun 8. Tämä prosessi on esitetty kuvan alaosassa. 1.
Kuvassa 2 Natrium- ja klooriatomien yhdistämisprosessi on esitetty. Tuloksena on natriumkloridi, jota myydään kaupoissa, joita kutsutaan suolaksi.
kuva 2. Natrium- ja klooriatomien yhdistämisprosessi
Tässäkin kukin osallistuja vastaanottaa puuttuvan määrän elektroneja toiselta: kloori kiinnittää yhden natriumelektronin omiin seitsemään elektroniinsä, kun taas se antaa atomit natriumatomille. Molemmissa ulomman kiertoradan atomissa on 8 elektronia, missä saavutetaan täydellinen sopimus ja vauraus.
Atomien valenssi
Atomeilla, joiden ulkoradalla on 6 tai 7 elektronia, on taipumus kiinnittää 1 tai 2 elektronia itseensä. He sanovat sellaisista atomeista, että ne ovat yksi tai kaksiarvoinen. Mutta jos atomin ulkokehällä on 1, 2 tai 3 elektronia, niin sellaisella atomilla on taipumus antaa heille pois. Tässä tapauksessa atomia pidetään yhtenä, kahden tai kolmenarvoisena.
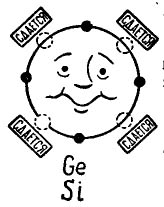
Jos atomin ulommalla kiertoradalla on 4 elektronia, niin sellainen atomi mieluummin yhdistyy samaan, jossa on myös 4 elektronia. Näin transistorien tuotannossa käytetyt germanium- ja piiatomit yhdistyvät. Tässä tapauksessa atomeja kutsutaan tetravalenttisiksi. (Germaniumin tai piin atomit voidaan yhdistää muihin alkuaineisiin, kuten esimerkiksi happea tai vetyä, mutta nämä yhdisteet eivät ole mielenkiintoisia tarinasi suunnitelmassa.)
Kuvassa 3 esitetään germanium- tai piiatomi, joka haluaa yhdistyä samaan atomiin. Pienet mustat ympyrät ovat atomin omia elektroneja, ja valopiirit osoittavat paikkoja, joissa neljän atomin - naapurien - elektronit putoavat.
kuva 3. Germaniumin (piin) atomi.
Puolijohteiden kiderakenne
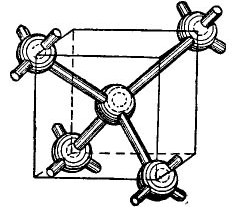
Jaksotaulukon germanium- ja piiatomit ovat samassa ryhmässä kuin hiili (timantin C kemiallinen kaava on yksinkertaisesti tietyissä olosuhteissa saatuja suuria hiilikiteitä), ja siksi ne yhdistyessään muodostavat timanttimaisen kiteisen rakenteen. Tällaisen rakenteen muodostuminen on esitetty kuviossa tietysti yksinkertaistetussa muodossa 4.
kuva 4.
Kuution keskellä on germaniumiatomi, ja kulmassa on vielä 4 atomia. Kuution keskellä kuvattu atomi on sidottu valenssielektroniensa avulla lähimpiin naapureihinsa. Kulma-atomit puolestaan antavat valenssielektroninsa kuution keskellä sijaitsevalle atomille ja sen naapureille - atomille, joita ei ole esitetty kuvassa. Siten ulommat kiertoradat täydennetään jopa kahdeksalla elektronilla. Tietysti kidehilassa ei ole kuutiota, se on vain esitetty kuviossa niin, että atomien keskinäinen, tilavuusjärjestely on selvä.
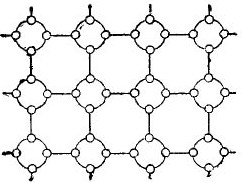
Mutta puolijohteita koskevan tarinan yksinkertaistamiseksi niin paljon kuin mahdollista, kidehila voidaan esittää tasaisen kaavamaisen piirroksen muodossa, huolimatta siitä, että interatomiset sidokset sijaitsevat silti avaruudessa. Tällainen piiri on esitetty kuvassa. 5.
kuva 5. Germaniumkiteiden ristikko on litteä.
Tällaisessa kidessä kaikki elektronit ovat kiinnittyneet tiukasti atomiin valenssisidoksillaan, joten ilmeisesti täällä ei yksinkertaisesti ole vapaita elektroneja. Osoittautuu, että edessämme on kuvassa eriste, koska siinä ei ole vapaita elektroneja. Mutta itse asiassa tämä ei ole niin.
Sisäinen johtavuus
Tosiasia on, että lämpötilan vaikutuksesta jotkut elektronit edelleen onnistuneesti eroavat atomistaan ja vapautuvat jonkin aikaa sitoutumisesta ytimen kanssa. Siksi germaniumkiteessä on pieni määrä vapaita elektroneja, joiden vuoksi on mahdollista johtaa sähkövirta. Kuinka monta vapaata elektronia esiintyy germaniumkiteessä normaaleissa olosuhteissa?
Tällaisia vapaita elektroneja ei ole enempää kuin kaksi 10 ^ 10 (kymmenen miljardia) atomia kohti, joten germanium on huono johdin, tai kuten on tapana sanoa puolijohde. On huomattava, että vain yksi gramma germaniumia sisältää 10 ^ 22 (kymmenentuhatta miljardia miljardia) atomia, mikä antaa sinun "saada" noin kaksi tuhatta miljardia vapaata elektronia. Vaikuttaa siltä, että se riittää suuren sähkövirran siirtämiseen. Tämän asian käsittelemiseksi riittää, että muistamme, mikä virta on 1 A.
1 A: n virta vastaa johtimen läpi kulkemista yhdessä sekunnissa 1 varauksen, tai 6 * 10 ^ 18 (kuusi miljardia miljardia) elektronia, sekunnissa. Tätä taustaa vasten kaksi tuhat miljardia vapaata elektronia, jotka ovat jopa hajallaan valtavan kiteen yli, eivät todennäköisesti takaa suurten virtojen kulkua. Vaikka Saksassa on lämpöliikkeen takia pieni johtavuus. Tämä on ns. Luontainen johtavuus.
Elektroninen ja reikäjohtavuus
Lämpötilan noustessa lisäenergia siirtyy elektroneihin, niiden lämpövärähtelyt muuttuvat energisemmiksi, minkä seurauksena jotkut elektronit onnistuvat murtumaan atomistaan.Nämä elektronit vapautuvat ja ulkoisen sähkökentän puuttuessa tekevät kaoottisia liikkeitä ja liikkuvat vapaassa tilassa.
Atomit, jotka ovat menettäneet elektroneja, eivät voi tehdä satunnaisia liikkeitä, vaan heilahtelevat vain vähän suhteessa normaaliin asemaansa kidehilassa. Sellaisia atomeja, jotka ovat menettäneet elektroneja, kutsutaan positiivisiksi ioneiksi. Voidaan olettaa, että atomista revittyjen elektronien sijaan saadaan vapaita tiloja, joita kutsutaan yleisesti reikiksi.
Yleensä elektronien ja reikien lukumäärä on sama, joten reikä voi vangita lähellä olevan elektronin. Seurauksena on, että positiivisesta ionista peräisin oleva atomi muuttuu taas neutraaliksi. Elektronien ja reikien yhdistämisprosessia kutsutaan rekombinaatioksi.
Samalla taajuudella elektronit erotetaan atomista, joten keskimäärin tietyn puolijohteen elektronien ja reikien lukumäärä on yhtä suuri, vakio ja riippuu ulkoisista olosuhteista, erityisesti lämpötilasta.
Jos puolijohdekiteisiin kohdistetaan jännite, elektronien liike määrätään, kristallin läpi virtaa virta sen elektronien ja reikien johtavuuden vuoksi. Tätä johtavuutta kutsutaan luontaiseksi, se mainittiin jo hiukan korkeampana.
Puhtaat puolijohteet, joissa on elektroninen ja reikäjohtavuus, eivät kuitenkaan sovellu diodien, transistorien ja muiden yksityiskohtien valmistukseen, koska näiden laitteiden perusta on p-n (lue “pe-en”) -liitos.
Tällaisen muutoksen aikaansaamiseksi tarvitaan kahta tyyppiä puolijohteita, kahden tyyppisiä johtavuuksia (p - positiivinen - positiivinen, reikä) ja (n - negatiivinen - negatiivinen, elektroninen). Tämän tyyppiset puolijohteet saadaan seostamalla lisäämällä epäpuhtauksia puhtaisiin germanium- tai piikiteisiin.
Vaikka epäpuhtauksien määrä on hyvin pieni, niiden esiintyminen muuttaa suurelta osin puolijohteen ominaisuuksia, antaa sinulle mahdollisuuden saada puolijohteita, joilla on erilainen johtavuus. Tätä käsitellään artikkelin seuraavassa osassa.
Boris Aladyshkin, electro-fi.tomathouse.com
Katso myös osoitteesta electro-fi.tomathouse.com
: